上海有机所在苯酚选择性官能团化方面取得进展
文章来源:上海有机化学研究所 | 发布时间:2017-08-28 | 【打印】 【关闭】
苯酚类化合物是一种重要的大宗化工品,是制备许多高分子材料、药物、天然产物以及染料的重要原料。然而,高化学选择性和高区域选择性制备酚类衍生物却一直是合成化学领域中的挑战:第一,酚羟基具有较强的酸性和亲核性,使其反应位点多发生在酚羟基而非苯环上;第二,在亲电反应中,苯环中酚羟基的邻位和对位都具有很高的活性,从而降低了反应的区域选择性;第三,酚类是典型的富电子芳烃,在反应过程中容易氧化分解。
在以往的苯酚选择性转化中,大多采用酚羟基取代的导向基团,实现邻位碳氢键活化的间接策略,然而,作为最直接、原子经济性的策略,直接使用自由酚羟基作为导向基团,合成高取代酚类衍生物,尽管进展不多,却一直是合成化学家们努力的方向。
中国科学院上海有机化学研究所有机功能分子合成与组装化学院重点实验室王东辉课题组,通过新颖的自由基反应设计,在铜的催化下,专一性地实现了自由酚类的邻位与亚甲胺基三氟硼酸钾的自由基偶联,并利用该策略实现了丝氨酸水解酶抑制剂的简捷合成(J. Am. Chem. Soc. 2017, 139, DOI: 10.1021/jacs.7b06785)。该反应具有原料简单易得、条件温和(80oC,弱碱)、操作简单(敞口反应)、收率高,且具有专一的酚羟基邻位选择性以及很好的官能团容忍度,对氮、氧杂环的底物同样适用的优点,也为活性药物先导化合物的合成提供了简便、快速、低成本的方法(图示1)。该反应策略也为初级化工品精细化提供了新思路。
该研究工作得到了中组部、科技部以及中国科学院战略性先导科技专项(B类)的资助。
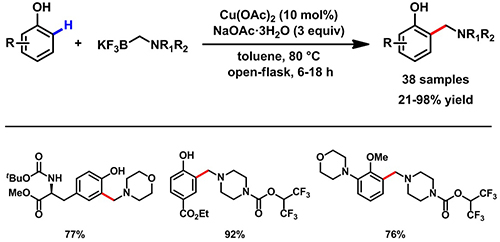
图示1. 铜催化的酚类邻位选择性亚甲胺基化反应
