生化与细胞所科研人员揭示成体心内膜形成冠状动脉的潜能
文章来源: | 发布时间:2018-02-09 | 【打印】 【关闭】
1月 26 日,国际学术期刊Circulation Research 在线发表了中国科学院生物化学与细胞生物学研究所周斌研究组的研究成果 “Genetic fate mapping defines the vascular potential of endocardial cells in the adult heart”。在该项工作中,研究人员利用特异性标记成体心内膜的Npr3-CreER小鼠,揭示成体心内膜在正常生理和各种心脏损伤模型中并不能转分化为冠状内皮细胞。进一步研究发现,当成体心内膜通过体外移植或是体内心脏损伤模型重新定位到心肌细胞层后,可以转分化为冠状血管内皮。由此,本研究揭示了成体心内膜在心脏损伤模型中的转分化潜能,有助于进一步深入了解成体心内膜的作用,为心血管再生医学研究提供新的思路。
冠状动脉疾病引起心肌梗死和心衰,是人类因疾病死亡的首要原因。促进冠状血管新生对治疗心肌梗死具有非常重要的意义。然而,心血管损伤修复的细胞来源和分子机制尚未全面了解。发生急性心梗后,心肌细胞和血管内皮细胞大量死亡,仅少量心肌细胞分裂增殖。因此,如何提高心脏供血已经成为该领域的研究热点。前期相关研究发现出生后心脏具有重新生成冠状动脉的能力,心内膜是大部分冠状动脉的起源。而成体心脏损伤修复中心内膜是否能够转分化成血管内皮细胞从而提高心脏损伤修复能力尚不清楚。
为了系统地研究成体心内膜在正常生理和心脏损伤情况下的命运变化,博士后唐娟等研究人员在周斌研究员的指导下建立了特异性标记成体心内膜的谱系示踪系统,抗雌激素药物他莫昔芬(tamoxifen)诱导处理后,Npr3-CreER;R26-tdTomato小鼠可以特异和高效地标记成体心内膜细胞。利用这个特异性的成体心内膜标记小鼠,研究人员分别在生理情况以及心脏损伤情况下检测了心内膜的转分化情况。通过对4周 Npr3-CreER;R26-tdTomato小鼠注射tamoxifen,诱导Cre重组酶进入细胞核,使心内膜细胞永久地标记上 RFP,研究人员在注射后20以及62周时收取小鼠心脏样本,发现在稳态心脏中,心内膜细胞并不能转归为冠状血管内皮。进一步实验中,研究人员在tamoxifen 诱导的Npr3-CreER;R26-tdTomato小鼠中构建了心脏损伤模型,包括心肌梗死模型、心脏缺血再灌注模型、主动脉缩窄诱导纤维化模型和冰冻损伤模型。他们发现在心脏缺血再灌注模型、主动脉缩窄诱导纤维化模型以及冰冻损伤模型中,心内膜不能转分化为冠状血管内皮。但是在心肌梗死模型中,研究人员发现有极少量的心内膜转分化血管内皮细胞,揭示当心内膜被重新嵌入心肌细胞层后会获得冠状血管特性。为了进一步验证实验结果,研究人员分选出心内膜细胞,注射到野生型小鼠梗死心脏中,发现注射的心内膜细胞会转分化为冠状内皮血管细胞,而假手术组野生型小鼠并未检测到分化为冠状血管的心内膜细胞,提示在心内膜转分化冠状内皮细胞中缺氧微环境起着重要作用。最后,研究人员在Npr3-CreER;R26-tdTomato小鼠上构建了荷包缝合类似心脏损伤模型,荷包缝合类似损伤模型中心内膜重新嵌入到心肌层,在缺氧等外界微环境的刺激下转分化成冠状血管内皮和小的冠状动脉。以上结果说明,成体心内膜在特定的情况下具有转分化为冠状血管内皮细胞的潜能。
该研究工作得到香港中文大学吕爱兰教授等的大力支持,同时得到中国科学院、国家基金委、国家科技部、上海市科委等资助。
文章链接:http://circres.ahajournals.org/content/early/2018/01/25/CIRCRESAHA.117.312354
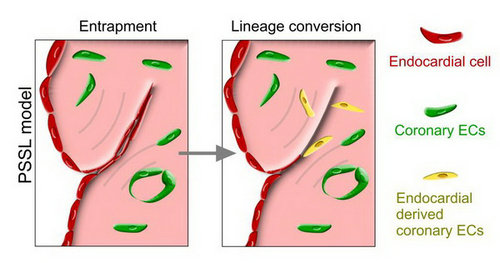
图:在小鼠荷包缝合类似心脏损伤模型中,心内膜嵌入到心肌层在缺氧等微环境刺激下形成冠状血管内皮细胞
