中国科学院上海营养与健康研究院潘巍峻研究员带领其研究团队,在国际上首次高清晰解析了体内造血干细胞归巢的完整动态过程。北京时间11月20日凌晨,该研究成果于在国际知名学术期刊Nature(《自然》)在线发表。
造血干细胞可以通过增殖分化产生红细胞、白细胞、血小板等人体内所有类型的血液细胞,而造血干细胞能够自我更新和向下游分化从而建立整个血液系统的关键前提是其向造血组织的“归巢”。“归巢”通常指循环系统中的特定细胞类群定向迁移至生物体组织或器官微环境,维持或重塑其细胞命运的生命过程。
造血干细胞归巢的概念由来已久,基于其归巢能力的造血干细胞移植已在临床被广泛应用于血液、免疫和肿瘤等重大疾病的治疗。但由于该生命过程的时空跨度非常大,观察手段十分有限。虽然科研人员在过去几十年的研究过程中,对归巢的细胞和分子基础进行了一定的解析,但归巢在体内生理情况下究竟如何发生,归巢的微环境究竟是何种结构,微环境细胞又是如何帮助造血干细胞归巢的等一系列关键科学原理依然知之甚少,严重制约了临床造血干细胞移植等相关技术的发展。
为攻克这一科技难题,潘巍峻研究员带领其团队历时6年,在优化活体成像技术的基础上,进一步整合活体免疫荧光标记、遗传调控和图形重构计算等方法,首创了一套全新的可以完整解析体内造血干细胞归巢全过程的研究体系。研究人员在国际上率先采用可变色荧光蛋白建立了造血干细胞标记系统,在高分辨率共聚焦荧光显微镜下,建立了造血干细胞长时程活体观察追踪方案,从宏观到微观,生动地呈现了造血干细胞从诞生到归巢的全过程。经过对大规模长时程活体成像的统计分析,发现了造血干细胞归巢的时空规律及“热点区域”,并结合精细成像和三维重构技术,首次揭示了体内造血干细胞归巢微环境的独特微血管结构。
在研究过程中,他们还意外地发现了一种全新的微环境细胞,并将其命名为“先导细胞”。这类细胞是一种之前未被定义过的巨噬细胞新亚型,存在于归巢“热点区域”附近,它们可以识别进入造血组织的造血干细胞并将其引入特定的血管结构中,从而实现造血干细胞的归巢。
这是由中国科学家独立完成的原创性科学发现,研究过程中突破了现有理论及研究体系,以独特的视角呈现了造血干细胞在生物体内归巢的全过程。开启了国际上造血干细胞领域的在体长时程、高分辨研究新时代。该工作不仅回答了“体内的造血干细胞归巢如何发生”这一世界造血干细胞研究领域的重大科学问题,而且发现了对于造血干细胞归巢起关键引导作用的“先导细胞”,为提高造血干细胞移植效率的转化研究提出了新理论,开创了新思路。
上述研究成果由潘巍峻研究员带领李丹彤、薛文志和李美等研究生,与中国科学院生物化学与细胞生物学研究所李林、陈剑峰、周波研究员,中国科技大学姚雪彪教授,耶鲁大学医学院吴殿青教授等协同攻关下共同完成,并得到了西南大学罗凌飞教授和香港科技大学温子龙教授的帮助。
此项成果得到了中国科学院“细胞命运可塑性的分子基础与调控”战略先导计划和装备研制计划、科技部国家重点研发计划专项、国家自然科学基金面上项目、上海市科委基础重点项目等的支持。(科技处)
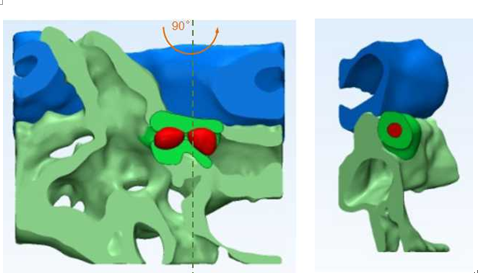
图1:造血干细胞归巢停留“热点区域”的三维重构模型
(红色代表造血干细胞,蓝色代表动脉,绿色代表静脉。)
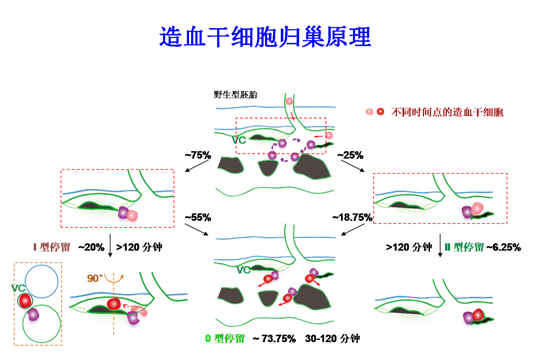
图2: “先导细胞”引导造血干细胞进入血管微环境的原理图(紫色细胞为“先导细胞”,VC指示静脉微血管,绿色代表血管)

图3: 潘巍峻研究员及其核心研究团队
(后排从左向右为此项研究成果的共同第一作者李美、李丹彤、薛文志。)
