分子细胞科学卓越创新中心杨巍维组合作发现丙酮酸脱氢酶在肿瘤免疫逃逸中的新功能
文章来源:分子细胞科学卓越创新中心 | 发布时间:2022-03-24 | 【打印】 【关闭】
3月21日,国际学术期刊Nature Metabolism在线发表了中国科学院分子细胞科学卓越创新中心(生物化学与细胞生物学研究所)杨巍维研究组、赵允研究组与上海交通大学附属胸科医院姚烽团队的合作研究成果:“MAPK signalling-induced phosphorylation and subcellular translocation of PDHE1α promotes tumour immune evasion”。该研究揭示了丙酮酸脱氢酶PDHE1α亚细胞转位促进肿瘤免疫逃逸的功能及其机制。
肺癌是全球癌症相关死亡的最常见原因,肺癌的治疗仍然是一个巨大的挑战。尽管针对免疫检查点的靶向治疗(抗PD-1治疗、抗PD-L1治疗等)在许多恶性肿瘤的治疗中展现出显著的成效,并且已经在晚期肺癌的治疗中发挥了重要作用,但并非所有PD-1阳性的肺癌患者都能从抗PD-1治疗中获益。解决肿瘤细胞对抗PD-1治疗的耐药性将具有重要的临床意义。
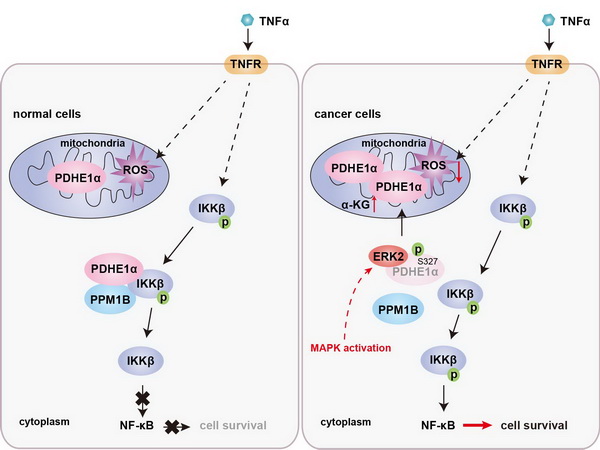
丙酮酸脱氢酶复合物在线粒体中催化丙酮酸转化为乙酰辅酶A,桥接糖酵解与三羧酸循环代谢。杨巍维组的最新合作研究发现丙酮酸脱氢酶复合物E1组分α亚基(PDHE1α)存在丰富的胞质定位;胞质PDHE1α通过促进磷脂酶PPM1B对IKKβ S177/181(IKKβ激活的关键磷酸化位点)的去磷酸化削弱了NF-κB信号通路的激活,增强了炎症因子及细胞毒性T淋巴细胞(CTLs)诱导的肿瘤细胞死亡。然而,MAPK等致癌信号(oncogenic signaling)的激活,导致胞质PDHE1α S327位点被ERK2磷酸化并转位到线粒体;胞质PDHE1α水平的下降恢复了NF-κB信号通路的活化;同时,线粒体PDHE1α的增多提升了α-酮戊二酸的含量,并促进炎症因子刺激下肿瘤细胞的ROS解毒。NF-κB的活化和ROS的清除共同促进了肿瘤细胞在炎症因子刺激下的存活,增强了肿瘤细胞对CTLs的耐受性,最终促进了肿瘤的免疫逃逸和抗PD-1治疗的耐药性。
此外,肺癌患者肿瘤组织中PDHE1α S327磷酸化水平与胞质PDHE1α水平、ERK2活性和NF-κB激活相关;胞质PDHE1α水平或PDHE1α S327磷酸化水平与肺癌患者的恶性程度和预后相关。
该工作发现了PDHE1α亚细胞转位在肿瘤免疫逃逸中的新功能;揭示了磷酸化调控PDHE1α亚细胞转位及PDHE1α亚细胞转位调控肿瘤免疫逃逸的新机制;提示了抑制PDHE1α的磷酸化可以阻断肿瘤的免疫逃逸并提高肿瘤免疫治疗的疗效。
分子细胞卓越中心杨巍维研究员、赵允研究员和上海交通大学附属胸科医院姚烽副主任医师为该论文的共同通讯作者。杨巍维组张亚娟副研究员和博士研究生赵明为该论文的共同第一作者。该项研究工作得到了国家重点研发计划项目、国家自然科学基金、中国科学院青年基础研究项目等资助。该项研究工作得到了分子细胞卓越中心细胞生物学技术平台、化学生物学技术平台和动物实验技术平台的支持。
文章链接:https://www.nature.com/articles/s42255-022-00543-7。
MAPK信号诱导的PDHE1α的磷酸化和转位促进肿瘤免疫逃逸
