分子细胞卓越中心周斌研究组揭示心脏驻留型巨噬细胞的发育起源
文章来源:分子细胞科学卓越创新中心 | 发布时间:2022-06-30 | 【打印】 【关闭】
6月6日,国际学术期刊Journal of Cell Biology发表了中国科学院分子细胞科学卓越创新中心周斌研究组研究成果“Lineage tracing clarifies the cellular origin of tissue resident macrophages in the developing heart”。该研究利用多种遗传谱系示踪系统,在小鼠体内分别实现对心脏心内膜、卵黄囊(yolk sac, YS)内皮细胞、主动脉-性腺-中肾区(aorta-gonads-mesonephros, AGM)内皮细胞高效率、特异性的标记,揭示了在胚胎发育期心脏驻留型巨噬细胞主要起源于YS内皮的初级造血(primitive hematopoiesis)和短暂次级造血(transient definitive hematopoiesis)作用以及随后的AGM内皮的次级造血(definitive hematopoiesis)作用。
心脏作为“机体发动机”对维持人类生命活动至关重要,多种心血管疾病引起的心功能失常严重威胁人类健康,例如心肌梗死、心肌炎症、冠心病、高血压等,已成为人类死亡的重要原因。心脏驻留型巨噬细胞是心脏的重要组成部分,在心脏稳态维持和损伤再生中发挥着重要调控作用,例如调控胚胎期心脏冠状动脉血管和淋巴管新生,维持心脏传导系统正常功能,参与心脏损伤后的修复等。因此,阐明心脏巨噬细胞的发育起源将会为心脏发育及临床心脏损伤修复提供重要研究基础。
关于心脏驻留型巨噬细胞的发育起源并未完全清楚,一直存在科学争论。多项研究认为哺乳动物胚胎期组织驻留型巨噬细胞起源于早期的生血内皮(hemogenic endothelium),主要包括YS区和AGM区生血内皮细胞。小鼠胚胎发育期主要存在三波造血活动,第一波最早来源于胚胎发育第7.5天(E7.5)左右YS血岛中的后板中胚层,产生早期的红系髓系前体细胞(eythro-myeloid precursors,EMPs),能分化为CD45+F4/80brightCD11blow巨噬细胞,可迁移至大脑形成小神经胶质细胞(microglia),这个过程称为初级造血。第二波起源于E8.0-E8.5天的YS造血内皮,能够产生晚期的EMPs,被认为是短暂次级造血。一旦血液循环系统在E8.5天左右建立,EMPs会随着血液循环定植于胎肝,并在胎肝扩增、分化为CD45+F4/80lowCD11bhigh巨噬/单核细胞。第三波来源于E10.5天左右AGM区生血内皮产生的造血干细胞(hematopoietic stem cells,HSCs),称为次级造血,这些HSCs在E10.5天左右移植于胎肝并继续承担造血活动,分化为包括CD45+F4/80lowCD11bhigh巨噬/单核细胞在内的多种谱系血细胞。鉴定并发现新的造血内皮类型一直是发育生物学领域的热点。近期,Haruko Nakano团队提出一个全新的概念,提出心脏心内膜也属于造血内皮,在胚胎早期能够进行造血活动,贡献到外周血细胞并分化为心脏驻留型巨噬细胞。在他们的报道中,首先使用Nkx2.5-Cre工具小鼠标记心内膜进行谱系示踪分析,发现Nkx2.5-Cre标记的心内膜在E9.5左右具有短暂造血活性,并且这些心内膜来源的血细胞能进入血液循环;之后再次利用Nfatc1-Cre工具小鼠标记心内膜细胞进行谱系示踪分析,进一步指出心内膜细胞在E9.5左右开始可以分化为心脏巨噬细胞,并指出这群巨噬细胞对心脏瓣膜的发育非常重要,被清除后会引起瓣膜发育异常。需要注意的是,在谱系示踪实验中,基因启动子表达的特异性将决定着报告基因对靶细胞标记的特异性。例如当基因a的启动子除了在A细胞表达外如果还表达在B细胞,那么在a-Cre;Rosa26-reporter小鼠中,报告基因会同时标记A细胞和B细胞,这会严重干扰谱系示踪结果的可靠性。所以在开展谱系示踪实验前,需要对遗传工具进行严格的特异性标记检测,这是谱系示踪结果可靠性的重要前提。有研究发现用来标记示踪心内膜细胞的Nkx2.5-Cre工具小鼠是具有争议的,Nkx2.5并不是心内膜特异性的分子标志物,Nkx2.5-Cre除了表达在心内膜还“异位”表达在YS和AGM区生血内皮。因此,揭示Nfatc1-Cre是否特异性标记心内膜细胞,并阐明心脏巨噬细胞发育起源这一科学争议是亟待解决的。
在本研究中,周斌组研究人员首先对Nfatc1的表达谱进行了详细阐明。他们构建了三种Nfatc1工具小鼠:Nfatc1-ires-Cre;R26-tdTomato, Nfatc1-2A-Dre;R26-RSR-tdTomato, 和 Nfatc1-2A-CreER;R26-tdTomato。通过利用这三种Nfatc1工具小鼠开展系统的谱系示踪实验,他们发现Nfatc1除了表达在心脏心内膜细胞,还表达在YS和AGM区内皮细胞,以及一些外周血免疫细胞中,包括巨噬细胞、单核细胞、中性粒细胞、T细胞和B细胞。以上结果揭示Nfatc1并不是心内膜特异性分子标志物,其标记的外周血巨噬细胞和单核细胞以及YS和AGM区的造血内皮将会对心内膜谱系示踪结果产生极大的干扰,因此心内膜是否属于造血内皮并具有造血活性仍然存在争议。为了解决这一问题,他们引进了两种新的心内膜工具小鼠:Mef2c-AHF-Cre;R26-tdTomato和Npr3-CreER;R26-tdTomato。通过系统的谱系示踪实验证实Mef2c-AHF-Cre能高效率地标记心房和流出道内皮细胞,同时Npr3-CreER能高效率、特异性地标记心内膜。进一步实验结果显示这些被标记的心内膜均不具备造血活性,不会分化为心脏驻留型巨噬细胞也不会标记外周血细胞。另一方面,利用Wt1-CreER;R26-tdTomato工具小鼠特异性标记心外膜细胞,研究人员也排除了心外膜具有造血潜能的可能性。因此,为了重新阐明心脏驻留型巨噬细胞的发育起源,他们构建了Cdh5-2A-CreER工具小鼠并验证其能高效率、特异性的标记造血内皮。通过对E7.5 Cdh5-2A-CreER;R26-tdTomato进行四羟他莫昔芬(4OHT)诱导,可以高效率示踪大脑microglia,提示YS造血内皮的初级造血和短暂次级造血作用被特异性、高效率地捕捉;而对E10.5 Cdh5-2A-CreER;R26-tdTomato进行4OHT诱导,则不会标记大脑microglia,提示AGM造血内皮的次级造血作用被特异性、高效率地捕捉,而不会受YS造血内皮的干扰。然后分别收集E16.5 Cdh5-2A-CreER;R26-tdTomato胚胎心脏进行分析,揭示在胚胎发育期心脏驻留型巨噬细胞主要起源于YS内皮的初级造血和短暂次级造血作用(比例约90%)以及随后的AGM内皮的次级造血作用(比例约15%)。本研究阐明心脏驻留型巨噬细胞的发育起源将为心脏发育及心脏疾病的临床免疫治疗提供重要研究基础。
分子细胞卓越中心及中国科学院杭州高等研究院周斌研究组博士后刘扩和博士后金恒薇为该论文共同第一作者,周斌研究员为该论文通讯作者。该研究得到分子细胞卓越中心动物实验技术平台、细胞分析技术平台和国家蛋白质科学研究(上海)设施的大力支持。该工作得到中国科学院、基金委、科技部、上海市科委等经费支持。
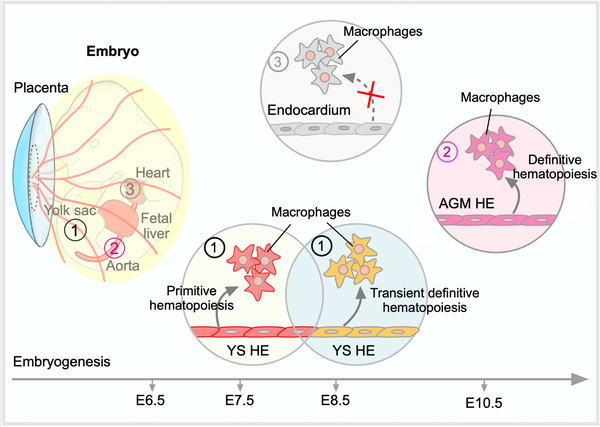
图注:胚胎发育期心脏驻留型巨噬细胞主要起源于①YS内皮的初级造血和短暂次级造血作用以及②AGM内皮的次级造血作用,不起源于③心内膜细胞。
