高栋组发现FOXA2驱动前列腺肿瘤细胞可塑性和KIT信号通路活化的机制
文章来源:分子细胞科学卓越创新中心 | 发布时间:2022-11-04 | 【打印】 【关闭】
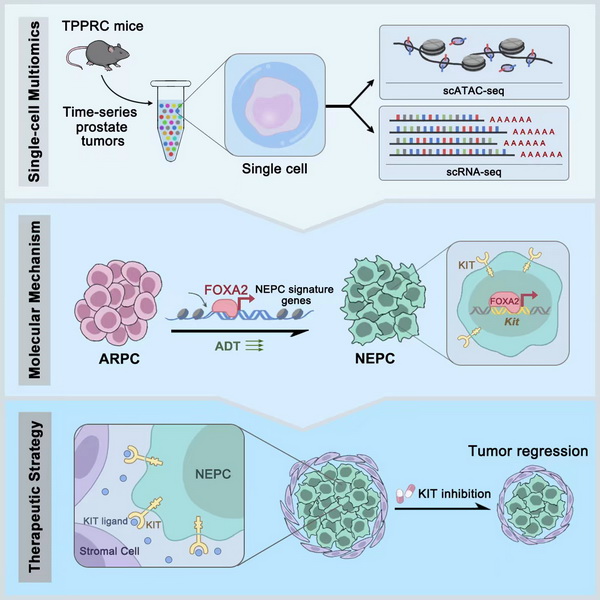
11月3日,国际学术期刊Cancer Cell在线发表了中国科学院分子细胞科学卓越创新中心高栋研究组题为 “FOXA2 drives lineage plasticity and KIT pathway activation in neuroendocrine prostate cancer”的研究论文。该研究工作揭示了FOXA2在调控前列腺腺癌向神经内分泌癌谱系转变和KIT信号通路活化过程中的关键作用,发现KIT抑制剂具有治疗神经内分泌前列腺癌的临床应用前景。
前列腺癌是欧美国家发病率第一,死亡率第二的男性恶性肿瘤,在我国男性中前列腺癌的发病率也呈快速上升趋势。早期前列腺癌是具有管腔细胞谱系特征的腺癌,其肿瘤细胞的存活高度依赖于雄激素受体(androgen receptor, AR)信号通路,因此基于靶向AR的雄激素剥夺治疗(androgen deprivation therapy, ADT)是早期前列腺癌病人的常用治疗方法。虽然大多数病人在治疗初期会产生应答,但是随着治疗时间的延长,会有相当一部分病人产生药物抵抗,并且进一步发展成为去势抵抗性前列腺癌。其中,神经内分泌前列腺癌是一种最为恶性的去势抵抗性前列腺癌。然而,目前针对神经内分泌前列腺癌并没有有效的治疗方法。在过去数年的诸多相关研究中,由转录因子调控的细胞谱系可塑性引起的肿瘤进展和治疗耐药得到了科学界的密切关注。同样在前列腺癌的研究中,腺癌-神经内分泌癌的谱系转变也被认为是诱导耐药性产生的重要因素。因此,鉴定直接驱动该谱系转变的调控因子, 以及开发能够直接用于临床治疗的潜在药物迫在眉睫。
为了寻找驱动前列腺癌谱系转变过程中的关键调控因子,研究人员利用Tmprss2CreERT2/+; Ptenflox/flox; Trp53flox/flox; Rb1flox/flox; ChgaLSL-tdTomato/+小鼠模型特异性地在管腔细胞中敲除Pten; Trp53; Rb1基因,同时在管腔细胞起始的腺癌细胞中利用tdTomato信号实时监测神经内分泌细胞的特征基因Chga的表达,构建了前列腺腺癌向神经内分泌癌谱系转变的小鼠模型。随后研究人员对前列腺腺癌向神经内分泌癌谱系转变不同进展阶段的小鼠前列腺肿瘤样本开展单细胞多组学测序,最终获得107201个高质量的单细胞多组学数据;对细胞异质性、转录调控和微环境进行分析后,鉴定出FOXA2作为前列腺腺癌-神经内分泌癌谱系转变的重要转录调控因子;进一步分析多个已发表的人前列腺肿瘤数据库、单细胞测序结果和肿瘤患者的组织样本,确认了FOXA2在神经内分泌前列腺癌中的重要作用。通过在神经内分泌肿瘤细胞中敲低FOXA2的表达,研究人员成功实现了将神经内分泌前列腺癌向腺癌的部分逆转,验证了FOXA2调控前列腺腺癌向神经内分泌癌谱系转变中的作用。
更重要的是,为了进一步寻找神经内分泌前列腺癌的治疗靶点,研究人员通过对肿瘤微环境和FOXA2的染色质免疫共沉淀(ChIP-seq)分析发现,FOXA2可以直接调控KIT信号通路使其在神经内分泌前列腺肿瘤细胞中特异性激活。通过基因工程小鼠以及人源类器官培养,确定KIT信号通路调控神经内分泌前列腺肿瘤的生长。使用靶向KIT的shRNA和多种临床级药物,如伊马替尼等均可以在体内和体外的情况下有效地抑制人和小鼠神经内分泌前列腺肿瘤的生长。
该工作探究了FOXA2在介导前列腺腺癌-神经内分泌癌谱系转变的分子机制,鉴定了KIT信号通路可以作为治疗神经内分泌前列腺癌的关键靶点。此外,该工作强调了转录因子在研究细胞谱系可塑性的重要性,为治疗由细胞可塑性引发的耐药性肿瘤提供了一定的理论基础。
分子细胞卓越中心高栋研究员为该论文的通讯作者,博士后李飞为共同通讯作者,博士生韩铭、博士后李飞、博士生张晔晗为共同第一作者。该研究得到中山大学孙逸仙纪念医院黄海教授、上海交通大学郑俊克教授和北京大学白凡教授的大力支持。该工作获中国科学院、国家自然科学基金委、科技部和上海市科委等经费支持。该工作得到分子细胞卓越中心基因组标签计划、动物实验技术平台、细胞生物学技术平台和化学生物学技术平台的支持。
文章链接:https://www.cell.com/cancer-cell/fulltext/S1535-6108(22)00502-5