STTT | 上海药物所合作揭示AMPK表观调控H3K9me2抑制肺癌转移的新机制
文章来源:上海药物研究所 | 发布时间:2023-03-21 | 【打印】 【关闭】
肺癌是历年来死亡率最高的恶性肿瘤之一,其死亡率居高不下主要是因为其极易发生转移。如今,原位肺癌的控制与治疗已趋成熟,但对于转移性肺癌依然缺乏有效的治疗手段。因此,深入研究肺癌转移的发病机理对于肺癌的控制与治疗至关重要。
上皮细胞间充质转化(Epithelial-mesenchymal transition,EMT)被认为是癌细胞扩散的关键驱动因素。EMT过程中常伴随着表观遗传学的染色质重塑,以CDH1为代表的上皮基因,从染色质活跃状态(以组蛋白乙酰化H3Kac和甲基化 H3K4me3为标志)转变为稳定抑制状态(以组蛋白甲基化:H3K27me2/3, H3K9me2/3 为标志),从而限制上皮基因的转录和表达,促进EMT发生。因此,靶向表观遗传学修饰是克服肿瘤转移的有效策略。
2023年3月6日,中国科学院上海药物研究所李佳团队联合临港实验室臧奕研究员以及上海肺科医院施宏医生,在国际知名期刊Signal Transduction and Targeted Therapy发表题为“Phosphorylation of PHF2 by AMPK releases the repressive H3K9me2 and inhibits cancer metastasis”的研究论文,揭示代谢调节核心分子AMPK(AMP-activated protein kinase)表观调控H3K9me2抑制肺癌转移的新机制。
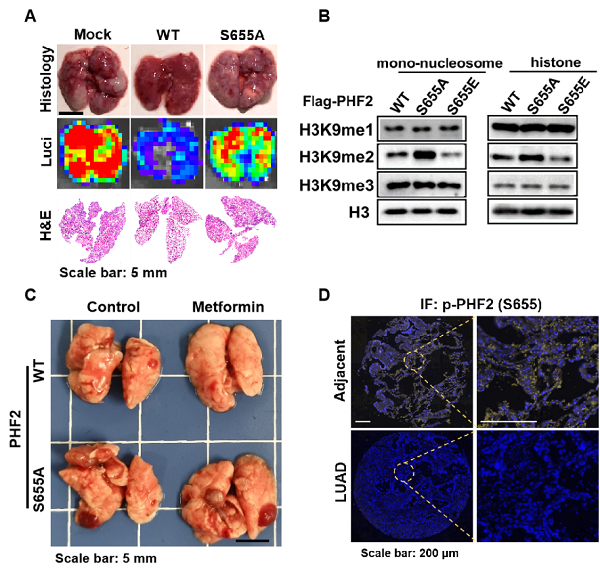
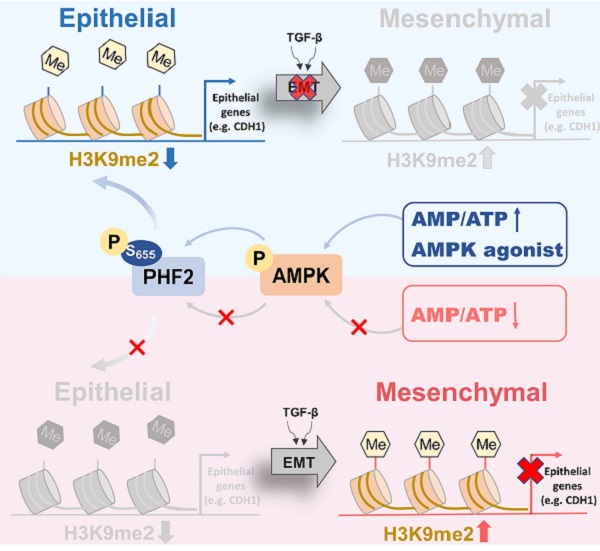
合作发现,利用二甲双胍激活AMPK能够抑制小鼠肺癌转移并下调H3K9me2水平。H3K9me2是经典的转录抑制标志物,也是恶性肿瘤进展中的常见染色质改变。机制研究发现,作用于H3K9me2位点的组蛋白去甲基酶PHF2是AMPK的下游磷酸化新底物。AMPK通过磷酸化PHF2-S655位点介导其发挥组蛋白去甲基化酶活,减少下游靶基因CDH1启动子区域的H3K9me2富集,从而抑制EMT的发生。研究人员还发现,AMPK所介导的PHF2-S655磷酸化水平在临床肺癌中显著降低,具有重要临床意义。
本研究通过揭示AMPK抑制肺癌转移在表观遗传领域的新底物和新机制,有助于拓宽AMPK的蛋白调控网络,促进二甲双胍的临床应用,并通过发现PHF2-S655磷酸化成为潜在的临床肺癌预后标志物,为肺癌的转移恶化提供新靶标。
上海药物所博士后董莹为本文独立第一作者。上海药物所李佳研究员、临港实验室臧奕研究员、上海肺科医院施宏医生为共同通讯作者。该项工作得到了上海药物所谭敏佳研究员、黄敏研究员、临港实验室黄洵研究员的帮助。该研究获得了国家自然科学基金、中国博士后科学基金、临港实验室、上海市科委扬帆计划、上海市肺科医院人才计划等项目的资助。
图A. S655A位点突变阻断PHF2抑制肺癌转移;图B. S655E突变促进PHF2发挥组蛋白去甲基化酶活,S655A反之抑制;图C. S655A突变阻断二甲双胍改善肺癌转移的作用;图D. PHF2-S655磷酸化水平在临床肺癌组织中显著下降。
AMPK表观调控H3K9me2抑制肺癌转移的新机制