分子植物卓越创新中心揭示肠道微生物介导的药物耐受新机制
文章来源:分子植物科学卓越创新中心 | 发布时间:2023-05-09 | 【打印】 【关闭】
2023年 5月8日,国际学术期刊Nature Metabolism在线发表了中国科学院分子植物科学卓越创新中心姜卫红研究组与合作者共同发表的研究论文,题为“Inactivation of the antidiabetic drug acarbose by human intestinal microbial-mediated degradation”。该研究发现了一种肠道微生物介导的药物分解代谢途径及关键酶,揭示了糖尿病一线药物阿卡波糖降解及耐药的新机制。
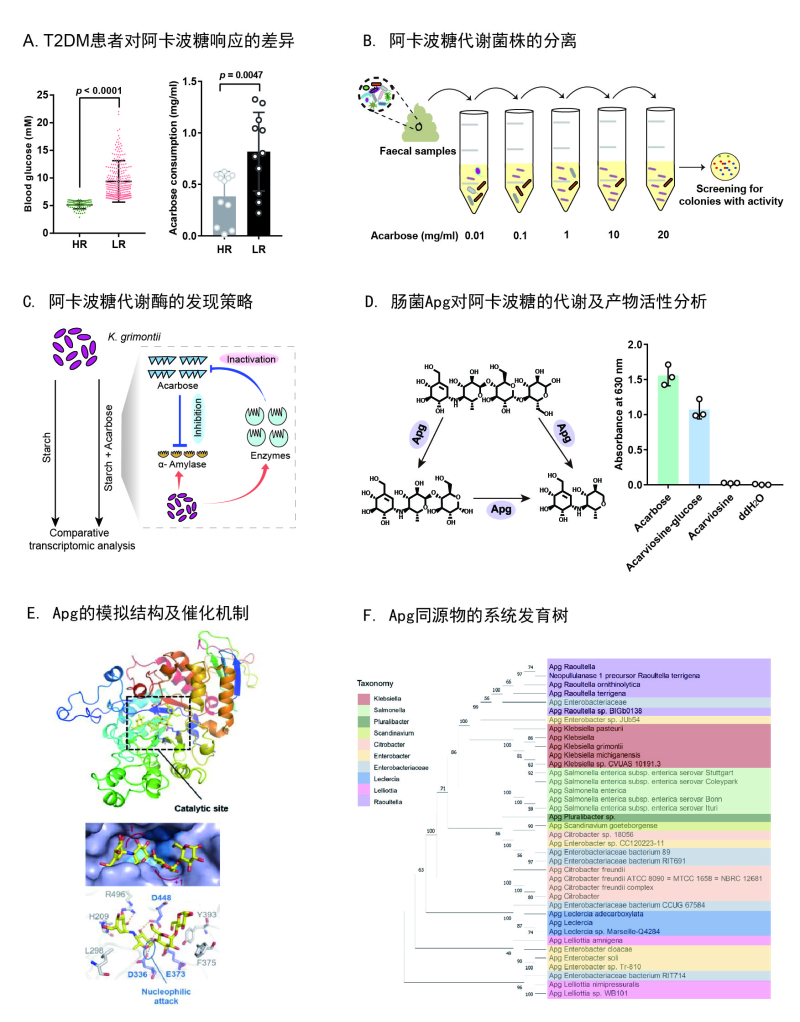
肠道微生物与人类协同代谢,在食物和药物的转化、修饰、降解及利用的过程中扮演着不可或缺的角色,是精准医疗中需要考虑的重要因素。阿卡波糖是治疗II型糖尿病(T2DM)的一线药物,它具有伪四糖结构,可作为α-葡萄糖苷酶的抑制剂而降低患者的血糖水平。然而,该药物临床效果个体差异较大,部分患者在长期使用后出现严重耐药。其潜在的机理,特别是肠道微生物的作用,仍有待阐明。
姜卫红研究组与郑州大学第一附属医院等单位合作,通过对临床样本的分析和微生物富集培养方法,确定了阿卡波糖耐药与肠道菌群之间的关联,并成功分离得到代谢阿卡波糖的主要肠道菌株Klebsiella grimontii TD1。进一步的宏基因组分析发现,阿卡波糖响应较弱的患者肠道中该菌的丰度较高,并且随着用药时间的延长其丰度有诱导上升的趋势。动物实验也表明,K. grimontii TD1能够大幅削弱阿卡波糖在T2DM模型小鼠体内的降糖效果。随后,研究组通过诱导富集表达谱和蛋白质谱分析等方法,在该菌中发现并鉴定了一种未报道的可代谢阿卡波糖的糖苷酶,命名为Apg(acarbose-preferred glucosidase)。该酶可以将阿卡波糖降解为含有三环和二环结构的小分子产物,而使其丧失药物功能。
此外,研究组还通过结构模拟阐释了Apg的关键功能基团和催化阿卡波糖降解的潜在分子机制。种系发育分析显示,Apg及其同源基因广泛存在于肠道微生物中,尤其是克雷伯氏菌属。这些结果表明,肠道细菌代谢引起的阿卡波糖耐药风险在人群中普遍存在,这种“诱导降解失活”机制可能是导致非抗生素耐药的主要原因之一。对于阿卡波糖低响应的患者,可考虑通过调节肠道微生态或靶向干预代谢酶的策略来减少耐药现象的发生。
中科院分子植物卓越中心博士后田进忠和博士研究生董志祥、郑州大学第一附属医院李冲博士、扬州大学杨云鹏研究员、临港实验室邢婧研究员为该论文的并列第一作者,中科院分子植物卓越中心姜卫红研究员和顾阳研究员、郑州大学第一附属医院秦贵军教授为共同通讯作者。该研究得到了中科院脑智卓越中心孙强研究组的大力支持,并获得国家自然科学基金委项目的资助。
文章链接:https://www.nature.com/articles/s42255-023-00796-w
实验结果图
