神经递质多巴胺(Dopamine)及其受体在人类中枢神经系统中扮演重要角色,它们参与调控诸如运动控制、认知功能、情绪调节和奖励机制等多种生理功能。异常的多巴胺信号传导与许多神经精神疾病关联,包括帕金森病、精神分裂症、抑郁症和成瘾等。药物分子的多重药理学(Polypharmacology)指的是一种药物可以同时作用于多个受体靶标的现象,某些不期望的靶向作用的发生往往伴随着毒副作用的产生。研究药物分子的多重药理特性一直是GPCR药理学领域的研究焦点和挑战。目前靶向多巴胺受体的抗帕金森病和精神分裂症等神经系统性疾病的药物多数存在多重药理学特性,然而关于其作用机理方面的研究匮乏,通过对多巴胺受体进行结构药理学研究,揭示药物分子多重药理活性产生以及药物分子对受体选择性的分子机制,有助于理解多巴胺受体系统激活,以及设计高效低副作用的多巴胺受体靶向药物。
多巴胺受体属于G蛋白偶联受体(GPCR)超家族,包含五个受体成员(D1R至D5R)。在过去十几年里,多个国际研究团队在多巴胺受体结构生物学方面取得了重大进展,这些进展极大地提高了学界对该系统机制的理解,并推动了针对多巴胺系统的药物开发。然而,D5R的结构以及激活态D4R的结构仍是该家族受体结构的空白,这在很大程度上限制了人们对多巴胺受体家族配体识别及激活机制的了解,成为了基于结构的靶向多巴胺受体药物研发的瓶颈。
2023年5月23日,中国科学院上海药物研究所徐华强研究员、北卡罗来纳大学教堂山分校Bryan Roth教授、浙江大学张岩教授、共同在Cell Research杂志上在线发表了他们最新的研究成果“Structural Genomics of the Human Dopamine Receptor System”,取得了多巴胺受体结构领域又一突破性进展。
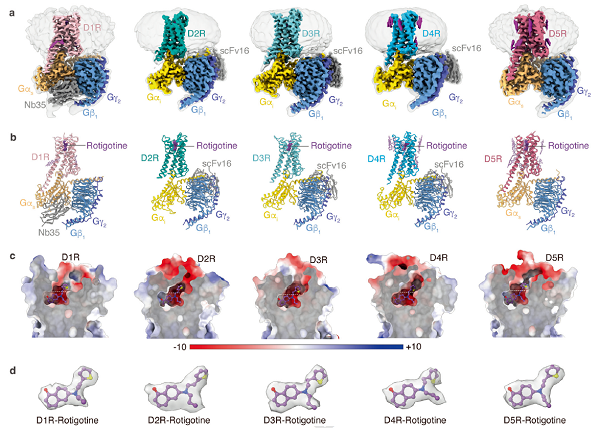
研究团队采用单颗粒冷冻电镜技术,成功解析了五种多巴胺受体分别结合同一种激动剂分子罗替高汀(Rotigotine)以及下游G蛋白的复合物结构,分辨率分别为3.2 埃 (D1R–Gs)、3.0 埃 (D2R–Gi)、2.7 埃 (D3R–Gi), 3.2 埃 (D4R–Gi)以及 3.1 埃 (D5R–Gs)。该成果首次揭示了D5R以及激活态D4R的结构,并且系统地分析了整个多巴胺受体系统的多重药理学以及信号转导机制。
尽管五种多巴胺受体都通过结合相同的内源性配体多巴胺来发挥生理功能,但是,受体之间的细微结构差别不仅能够影响它们与药物分子的亲和力,也能激活截然不同的信号转导效应。为了揭示受体之间的结构差别,研究人员对五种受体的结构进行了对比,发现D1样和D2样受体之间存在较明显的区别。这些区别体现在受体胞外和胞内的几个区域:包括第一个跨膜螺旋(TM1)的N端区域、三个胞外环(ECL1-3)、第五跨膜螺旋(TM5)和第六跨膜螺旋(TM6)的胞内部分、和第二胞内环(ICL2)。
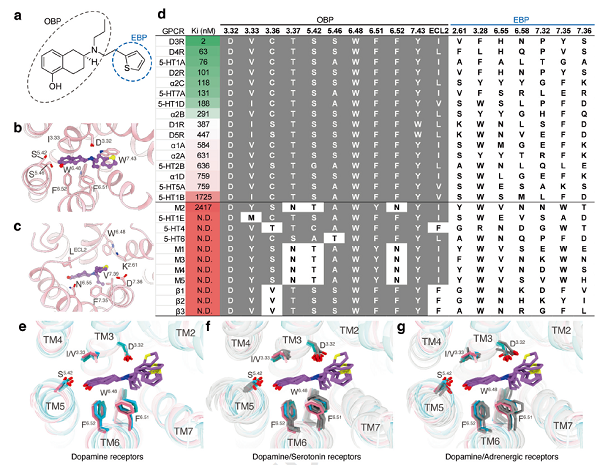
罗替高汀,一种用于治疗帕金森病和不宁腿综合症的药物,能够激活五种多巴胺受体,是具有多重药理学特性的典型药物分子。为了分析罗替高汀与不同多巴胺受体的结合基础,研究人员系统地对比了五种多巴胺受体与罗替高汀的结合模式,并通过药理学实验验证了配体与受体的相互作用。研究人员发现,多巴胺受体的配体结合口袋中下部分的氨基酸构成和结构相对保守,这部分被称为正构口袋(Orthosteric binding pocket, OBP),其结构在很大程度上决定了受体与配体的结合特性。然而,五种受体的配体结合口袋的中上部分存在较明显的差异,这部分被称为受体的延伸口袋(Extended binding pocket, EBP)。延伸口袋的结构非保守性使得罗替高汀在不同受体之间呈现构象差异,从而导致配体与受体亲和力的差异。
为了进一步研究不同受体的配体结合口袋与小分子多重药理学特性的关系,研究团队对罗替高汀进行了超过300种GPCR的结合活性筛选,发现罗替高汀不仅对多巴胺受体具有亲和力,还能结合其他多种GPCR,例如5-羟色胺受体(serotonin receptor)、肾上腺素受体(adrenergic receptors)、生长抑素受体(somatostatin receptors)、腺苷受体(adenosine receptors)和阿片受体(opioid receptors)等。通过结构和序列对比,研究人员发现配体的广谱结合能力与OBP的保守性有直接关联。
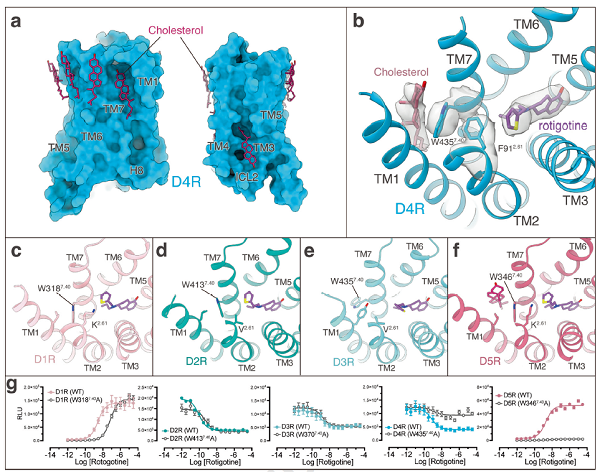
该研究还揭示了胆固醇对多巴胺受体功能的影响。研究团队发现,在D5R的第二胞内环附近的胆固醇分子稳定了色氨酸W3.52的构象,而D5R的近亲D1R在相同位点没有相应的胆固醇分子,这成为D1R别构调节剂具有高选择性的原因。同时,研究人员还发现在D4R的第一和第七个跨膜螺旋之间存在一个胆固醇分子,间接影响了配体与受体的结合。此外,研究团队还详细分析了多巴胺受体的激活机制以及结合下游信号蛋白的选择性机制。
总之,通过对多巴胺受体家族的系统性结构研究,该团队揭示了具有多重药理学特性的药物分子罗替高汀与五种多巴胺家族受体结合的结构基础,并拓展了学界对多巴胺受体配体识别基础、激活机制和信号转导机制方面的认识。
徐华强团队长期专注于多巴胺受体系统的结构药理学研究,并在近年来取得了一系列突破性成果。2021年2月,该团队在Cell杂志以封面论文形式发表了多巴胺受体D1R和D2R与G蛋白信号复合物结构的研究,率先揭示了多巴胺受体D1R与D2R的配体和G蛋白选择性机制 (Zhuang et al. Cell 2021)。2021年3月,该团队分别在Cell Research上发表了首个D1R与别构调节剂的复合物结构 (Zhuang et al. Cell Research. 2021),以及在Molecular Cell上发表了首个激活态多巴胺D3R受体结构 (Xu et al. Mol Cell. 2021)。
在前期研究的基础上,这项成果不仅填补了多巴胺受体结构解析的空白,还在多重药理学研究领域取得了重要进展。这些系统性的多巴胺受体研究极大地丰富了研究人员对多巴胺系统结构与功能的认识,并为帕金森病、精神分裂症、抑郁症等疾病药物研发奠定了坚实基础。
上海药物所徐沛雨博士(现为MIT博后)、黄思婕博士(现为UCSF博后)、北卡罗来纳大学教堂山分校的Brian Krumm博士、上海药物所副研究员庄友文以及浙江大学医学院附属邵逸夫医院研究员毛春友为本文的共同第一作者。上海药物所徐华强研究员、北卡罗来纳大学教堂山分校的Bryan Roth教授和浙江大学张岩教授为该项工作的共同通讯作者。该工作获得了包括科技部重点研发计划、上海市市级科技重大专项、中科院先导专项、国家自然科学基金委、中国科学院特别助理研究项目等基金的资助。
参考文献
1.Zhuang, Y. et al. Structural insights into the human D1 and D2 dopamine receptor signaling complexes. Cell 184, 931–942.e18 (2021).
2.Zhuang, Y. et al. Mechanism of dopamine binding and allosteric modulation of the human D1 dopamine receptor. Cell Res. 31, 593–596 (2021).
3.Xu, P. et al. Structures of the human dopamine D3 receptor-Gi complexes. Mol. Cell 81, 1147–1159.e4 (2021).
图1. 五种多巴胺受体的冷冻电镜结构和罗替高汀与多巴胺受体的结合模式
图2. 罗替高汀的多重药理学特性
图3. 胆固醇对多巴胺受体的调节作用
(供稿部门:徐华强课题组)