上海有机所交叉中心团队建立化学小分子与淀粉样蛋白聚集体互作基本理论
文章来源:上海有机化学研究所 | 发布时间:2023-07-12 | 【打印】 【关闭】
病理性淀粉样蛋白聚集是多种神经退行性疾病(如阿尔茨海默病和帕金森病等)的关键病理学标志物和治疗靶点。使用小分子靶向病理性的淀粉样蛋白纤维可用于多种神经退行性疾病的早期诊断和精准治疗。因此,临床上亟需特异性结合淀粉样蛋白纤维的小分子示踪剂和抑制剂。然而,由于淀粉样蛋白纤维的折叠组装结构与天然构象的蛋白具有显著差别,相比于靶向蛋白天然构象小分子设计与研发的海量知识与成功案例,目前,缺乏小分子配体与纤维相互作用的精确机制,使得我们无法基于结构研发特异性结合病理聚集体的化学小分子。
中国科学院生物与化学交叉研究中心刘聪课题组长期聚焦神经退行性疾病关键致病蛋白的相变聚集机制与化学调控研究,一系列工作揭示了淀粉样蛋白纤维结构的高度多态性,阐释了其与蛋白天然构象的本质差别,并揭示了其在帕金森病等神经退行性疾病发展中的关键作用(Nat Chem Biol,2021;Nat Rev Neurosci,2022)1,2。近期,研究团队聚焦“化学分子如何识别病理蛋白聚集体”这一蛋白相变聚集领域的核心科学问题,通过与上海交通大学Bio-X研究院李丹课题组合作,通过综合运用结构生物学、化学生物学等研究方法,首次系统地揭示了具有不同结构的小分子化合物与蛋白病理聚集体相互作用的基本原理。相关研究工作于2023年7月3日在Nature Chemical Biology期刊上发表,研究论文的题目为“Structural mechanism for specific binding of chemical compounds to amyloid fibrils”。该工作是对蛋白质-配体相互作用理论的革新,并为神经退行性疾病小分子示踪剂的合理设计和优化提供了结构基础。
在此项工作中,研究人员基于化合物库建立了高通量淀粉样蛋白纤维配体筛选方法,并由此方法发现了新的帕金森病致病蛋白α-突触核蛋白(α-synuclein,α-syn)纤维配体骨架。接下来,研究人员通过冷冻电镜螺旋重构技术解析了包括筛选获得的聚集体的配体,临床前显像示踪剂,以及经典淀粉样蛋白染料等9个不同结构的小分子与α-syn纤维结合的原子结构(图1)。这些结构信息揭示了小分子化合物与淀粉样蛋白纤维相互作用的基本机制,与传统的配体-天然蛋白质互作存在显著差异:天然蛋白质的配体结合口袋通常是三维的;淀粉样蛋白纤维的配体结合位点实际上是沟槽状,在纤维轴方向上是开放的,只有二维限制,因此配体需要建立沿纤维轴的相互作用限制,使其能够像天然蛋白质的配体一样特异性地结合。小分子之间的配体-配体π-π相互作用提供了这种特异性结合必需的限制。
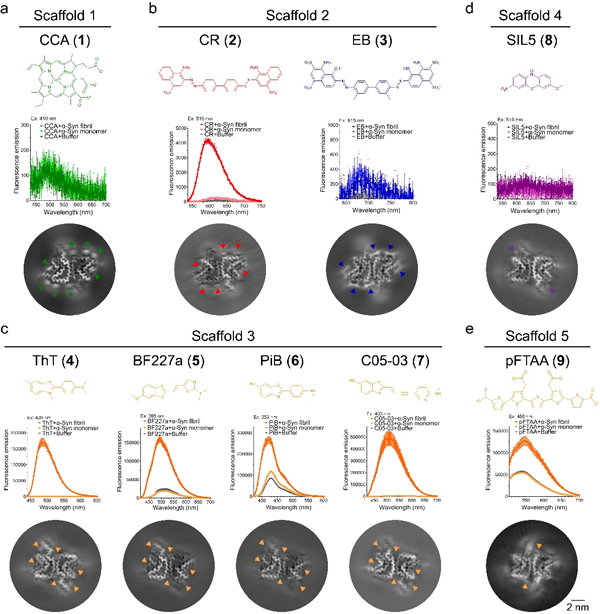
图2 化学小分子-淀粉样蛋白纤维复合物中的配体结合取向和特异性 综上,此项研究阐释了蛋白淀粉样聚集状态下独特的小分子配体结合模式,为基于结构开发能够特异识别蛋白聚集体的小分子示踪剂提供了重要的理论支持和技术平台。基于以上基础理论的探究,刘聪课题组与李丹课题组合作,正在综合运用基于原子结构的合理设计、基于高通量筛选的化合物骨架筛选,以及一系列动物模型、离体组织验证方法,以开发一系列能够特异性识别α-syn病理性聚集的小分子先导化合物,用于临床正电子发射断层扫描(PET)成像示踪剂的研发,从而推动帕金森病及相关突触核蛋白病的早期诊断以及精准病理分型的研究。相关成果将为迫切的临床诊断和治疗需求带来希望。 此项工作得到中国科学院生物与化学交叉研究中心谭立课题组、中国科学院上海有机化学研究所汤文军课题组大力帮助,得到中国科学院生物与化学交叉研究中心生物电镜平台、高通量药物筛选平台的技术支持。此项工作受到国家自然科学基金、国家重点基础研究发展计划、上海市科学技术委员会、中国科学院上海分院等基金的资助。 论文链接:https://www.nature.com/articles/s41589-023-01370-x 相关文献: 1 Li, D. & Liu, C. Hierarchical chemical determination of amyloid polymorphs in neurodegenerative disease. Nat Chem Biol 17, 237-245, doi:10.1038/s41589-020-00708-z (2021). 2 Li, D. & Liu, C. Conformational strains of pathogenic amyloid proteins in neurodegenerative diseases. Nat Rev Neurosci 23, 523-534, doi:10.1038/s41583-022-00603-7 (2022). 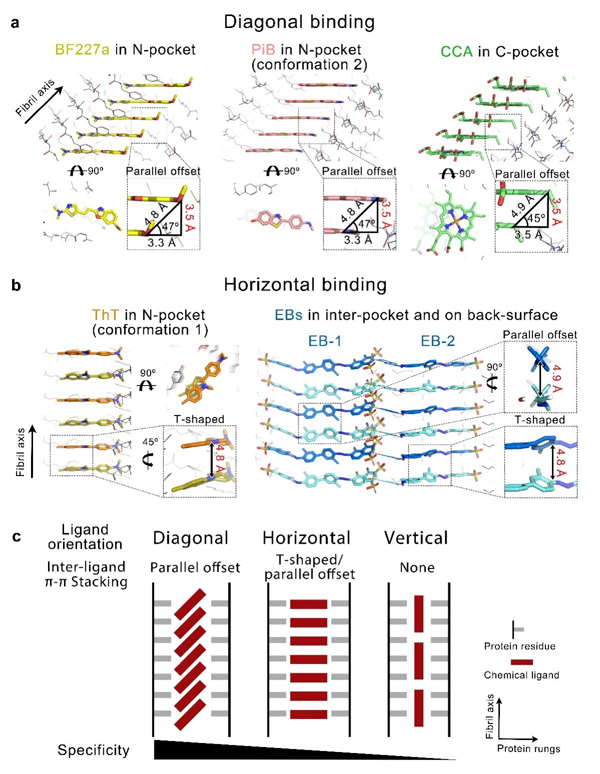
图1 不同小分子与α-syn纤维结合荧光变化和冷冻电镜密度图
研究人员进一步发现具有不同骨架的化合物能够通过多种不同的取向结合到α-syn纤维的不同结合位点(图2a、2b),并定义了配体识别并结合纤维的三种主要的取向及结合模式:对角线取向(diagonal geometry,小分子平面与纤维轴呈约45o角)、水平取向(horizontal geometry,小分子平面平行于蛋白分子平面)、垂直取向(vertical geometry,小分子平面垂直于蛋白分子平面)。三种取向对应不同形式的配体-配体π-π相互作用,以及依次降低的结合特异性(图2c)。因此,除了传统的配体-蛋白质相互作用,配体-配体相互作用协同贡献了小分子结合淀粉样蛋白纤维的特异性。此外,研究人员在体外重组的α-syn纤维和来自多系统萎缩患者的离体α-syn病理纤维结构中发现了一个可靶向的高度保守的配体结合口袋。为基于此口袋的广谱型α-syn纤维示踪剂设计、筛选和优化提供了重要的设计思路和靶点。
