4月9日,中国科学院分子细胞科学卓越创新中心(生物化学与细胞生物学研究所)宋昕阳研究员受邀在国际学术期刊Cell Host & Microbe上发表了题为:"Phyto-metabolites on guard: role of gut microbial deglycosylation”的科学评述(Preview),对近期发表在Cell期刊上题为:"Functional diversification of dietary plant small molecules by the gut microbiome”的研究进行了点评。
日常膳食纤维的充分摄入与人体健康息息相关。比如,结构复杂的膳食纤维多糖可经过肠道微生物的水解与发酵(hydrolysis and fermentation)形成具有免疫调节与能量供给功能的短链脂肪酸(short-chain fatty acids),包括乙酸,丙酸及丁酸等。除膳食纤维多糖以外,蔬果等植源性食物还富含次生代谢产物(plant secondary metabolites,PSMs)。这些PSM分子包括植物通过自身糖基转移酶催化形成的单酚或多酚类糖苷化合物(monophenolic or polyphenolic glycosides)。当这些植物糖苷经机体摄入后,其β-或α-糖苷键可被特异性水解,从而释放出结构多样的糖苷配基(aglycones)。拟杆菌(Bacteroides)是人体肠道中占主导地位的革兰氏阴性细菌,携带有丰富的碳水化合物活性酶系统(carbohydrate-active enzymes,CAZymes)。这些CAZymes包括糖苷水解酶(glycoside hydrolases,GHs),多糖裂解酶(polysaccharide lyases)及碳水化合物酯酶(carbohydrate esterases)等组分。以拟杆菌为代表的共生菌CAZymes已被报道广泛参与膳食纤维多糖及宿主粘液素多糖的水解过程。然而,肠道共生微生物是否参与到植物糖苷的水解过程,不同菌株间CAZymes是否存在功能差异,其相关水解产物是否具有生物活性,这些问题仍是领域内的未解之谜。
近期,来自美国波士顿儿童医院的Seth Rakoff-Nahoum教授团队取得相关突破性研究进展。他们采用多组学结合的研究手段揭示了肠道拟杆菌的植物糖苷水解途径,并初步探索了相关糖苷配基类代谢产物对病原微生物及宿主免疫系统的调控作用。该研究发现,不同门类的肠道共生菌对植物糖苷表现出差异化的代谢能力,而拟杆菌是其中的典型代表。借助转座子插入测序(transposon insertion sequencing,Tn-seq)等技术手段,研究团队解析了拟杆菌属中不同菌株植物糖苷水解能力差异的分子机制,揭示了不同菌株利用糖苷水解酶GH16或GH3家族完成植物糖苷水解的差异化策略。研究还进一步阐明了不同糖苷配基产物的结构特性与生理功能,初步验证了拟杆菌代谢产生的酚类糖苷配基具有抗菌活性和免疫调节作用。这项工作创新性地构建了“植物糖苷-微生物酶系统-宿主调控”的研究框架,拓展了我们对于共生微生物糖苷水解酶的底物选择性及其生物学功能的认知,为基于微生物CAZymes的肠道稳态调控及疾病靶向治疗提供了重要的理论依据。
分子细胞卓越中心宋昕阳组博士生罗孟泞为本文的第一作者,宋昕阳研究员为通讯作者。该项工作得到中国科学院B类先导专项、中国科学院“未来伙伴网络专项”、科技部国家重点研发计划、国家自然科学基金委以及上海市科委等部门的经费支持。
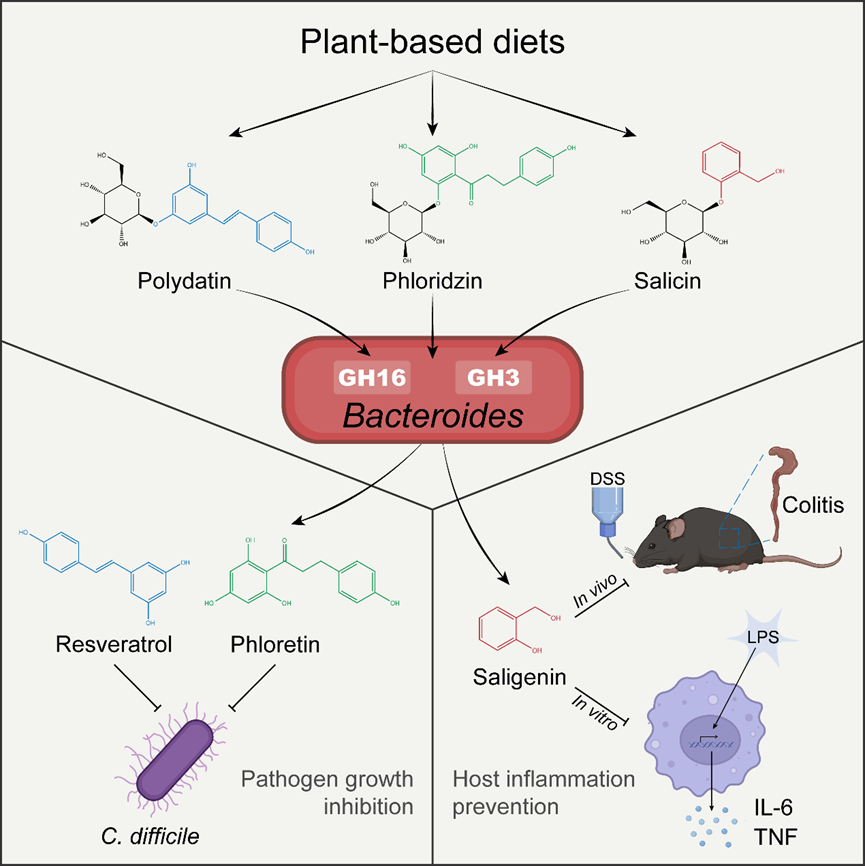
肠道拟杆菌通过糖苷水解酶产生具有抗菌或抗炎活性的植物次级代谢分子
文章链接:https://www.cell.com/cell-host-microbe/abstract/S1931-3128(25)00094-0

