2025年4月14日,《Neuron》期刊在线发表题为《A Time Window for Memory Consolidation During NREM Sleep Revealed by cAMP Oscillation》的研究论文。该研究由中国科学院脑科学与智能技术卓越创新中心(神经科学研究所)徐敏研究组与上海交通大学医学院张思宇研究组合作完成。研究团队通过光纤记录、光遗传调控和学习记忆行为学实验等技术,结合新型环磷酸腺苷(cAMP)荧光探针,首次揭示了非快速眼动(NREM)睡眠期海马-皮层网络中周期为60秒的cAMP超低频振荡。在cAMP水平升高的时间窗口中,海马CA1区与前额叶皮层(mPFC)的功能连接显著增强,特异性抑制该时间窗口海马神经元活动可显著破坏空间记忆巩固。该发现为理解睡眠依赖的记忆巩固机制提供了新的视角,为研发睡眠期人工记忆干预的新方法提供了重要参考。
记忆是大脑神经活动留下的"痕迹",其本质是神经突触的可塑性变化。当神经活动发生时,不仅会改变神经细胞的放电模式,还会通过G蛋白偶联受体(GPCR)激活细胞内复杂的信号传导网络。记忆的形成,正是依赖于这种放电活动与胞内生化信号之间的精密配合。虽然我们已经对记忆形成过程中神经放电活动有了较为深入的认识,但对其中细胞内信号的实时动态变化仍知之甚少。研究团队注意到,GPCR激活的主要下游信号之一为cAMP通路,且cAMP在多物种(包括海兔、果蝇和啮齿类动物)的学习记忆过程中均扮演着关键角色。基于这一发现,研究团队决定系统性地刻画cAMP在学习记忆过程中的动态变化规律。
研究发现,小鼠在学习过程中,cAMP的动态变化与神经活动呈现高度同步性,但这种相关性在学习后的睡眠记忆巩固阶段发生了有趣的逆转——正相关转变为负相关。更有趣的是,在非快速眼动睡眠(NREM)期间,海马CA1脑区cAMP浓度表现出周期约1分钟的超低频振荡,这种振荡模式在整个海马-皮层网络中保持同步。进一步研究发现,这种超低频振荡主要由蓝斑去甲肾上腺素(NE)通过β1受体驱动,而乙酰胆碱和五羟色胺的调控作用则相对有限。
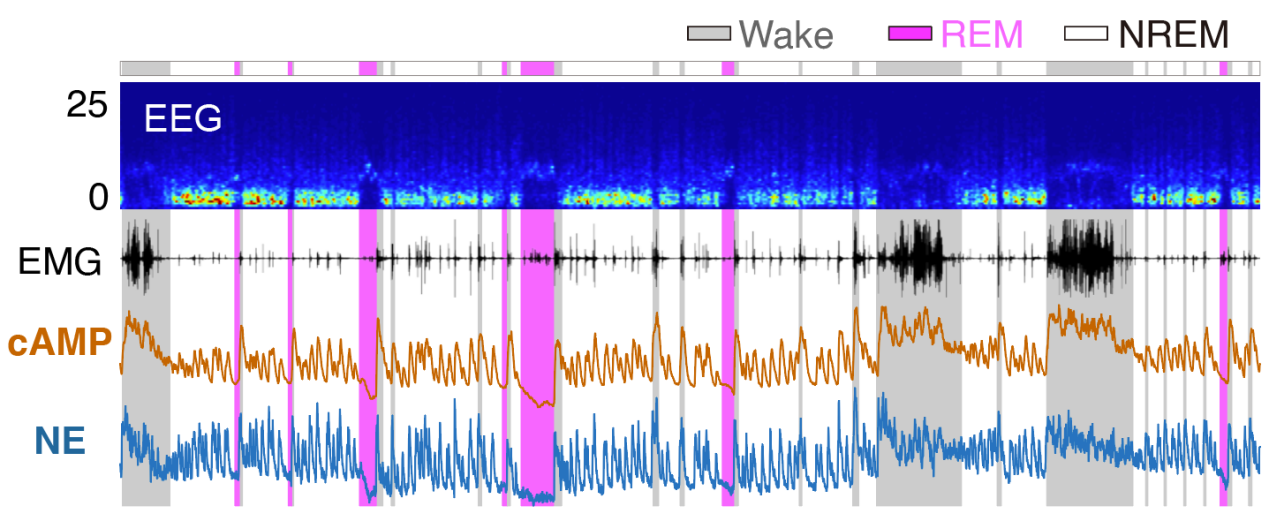
图1:在睡眠-觉醒周期中同时记录的海马CA1脑区的cAMP信号和同侧前额叶皮层的NE信号
基于cAMP和去甲肾上腺素等神经调质对突触可塑性的调控作用,研究人员提出假说:NREM睡眠中cAMP的周期性波动可能将睡眠划分为两种不同的功能状态——高cAMP浓度的"超可塑性"波峰期和低cAMP浓度的"非可塑性"波谷期;这两种亚状态期间记忆信息的处理可能有较大差别。为验证这一假说,研究团队采用闭环光遗传学技术精准操控海马CA1区神经活动,发现只有在cAMP振荡波峰期抑制神经活动才会显著损害空间记忆,而波谷期的干预则无显著影响。这一关键证据表明,cAMP振荡的波峰期构成了记忆巩固的"关键时间窗口",揭示了睡眠中记忆加工的精细时间调控机制。
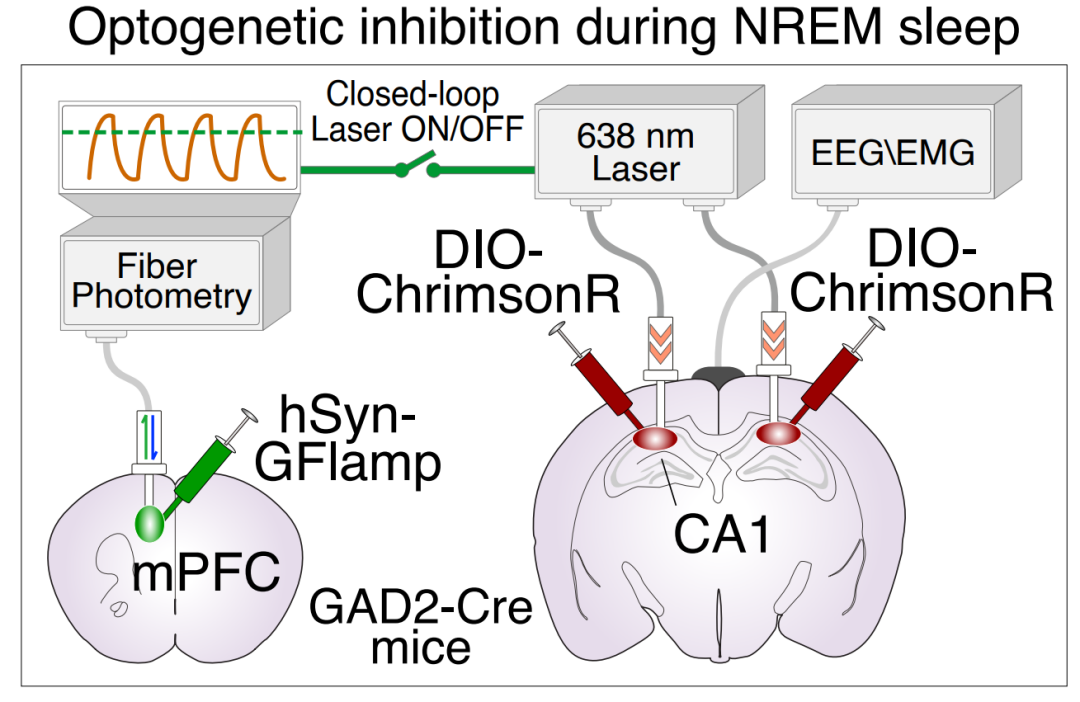
图2:NREM睡眠时期抑制海马CA1神经元活动的闭环操作
与上述发现相一致,研究人员进一步揭示海马与大脑皮层之间的功能连接在cAMP振荡达到波峰时显著增强。这一现象提示,此时存储在海马中的短期记忆可能正被更高效地传输至皮层进行长期储存。选择性抑制这一关键时间窗口的神经活动,会显著减弱海马-皮层网络的信息交流效率,从而破坏空间记忆的巩固过程。
本研究首次揭示在非快速眼动睡眠(NREM)期间海马-皮层网络中存在周期约60秒的同步cAMP超低频振荡。在这种独特的神经生理状态下,多种神经调质呈现同步释放,当cAMP和神经调质水平升高时,海马与大脑皮层的功能连接显著增强,在此时间窗口抑制海马神经元的活动可干扰空间记忆的巩固。总得来说,该研究为理解记忆巩固过程中胞内信号(cAMP)、神经调质系统(如去甲肾上腺素)和海马神经活动三者之间的动态关联及其复杂相互作用提供了新的视角,同时首次明确了NREM睡眠期cAMP水平动态变化所定义的、促进空间记忆巩固的关键时间窗口。
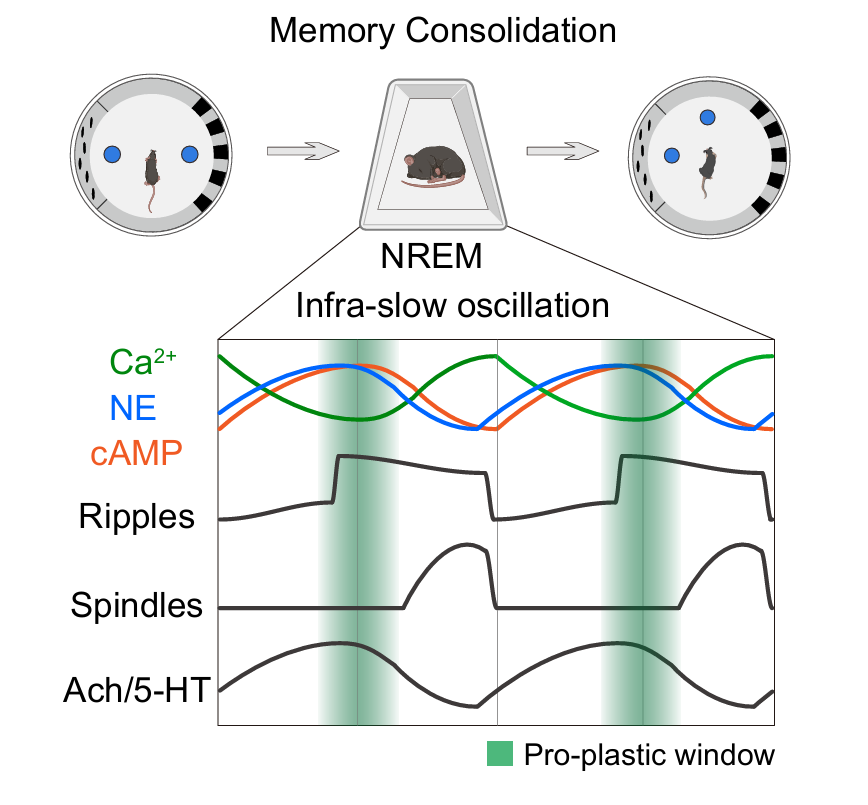
图3:NREM睡眠时期参与空间记忆巩固的各种生理信号的协调动态变化
本研究由中国科学院脑智卓越中心徐敏研究员和上海交通大学医学院张思宇研究员共同指导,博士研究生邓紫如和费翔作为共同第一作者完成。特别感谢深圳先进技术研究院储军研究员团队提供的cAMP探针技术支持。本研究获得国家自然科学基金委员会、上海市科学技术委员会及中国科学院等机构的资助。

