北京时间9月4日,国际学术期刊Cell在线发表了中国科学院分子细胞科学卓越创新中心(生物化学与细胞生物学研究所)王开乐研究组和MD安德森癌症中心Nicholas Navin团队合作的最新研究成果:“Coalescing single cell genomes and transcriptomes to decode breast cancer progression”。该研究通过开发高通量单细胞基因组和转录组联合测序方法wellDR-seq,实现了对12例乳腺癌中超过3万个单细胞进行双组学解析。这一突破性研究不仅直接鉴定并表征了ER阳性乳腺癌的肿瘤起始祖先亚克隆,更首次在单细胞水平定量描述了基因拷贝数(DNA)变化与基因表达(RNA)变化之间的复杂剂量调控关系,为乳腺癌的早期诊断、预后判断和精准治疗提供了全新的理论依据和技术路线。
乳腺癌是全球女性中最常见的恶性肿瘤之一,其巨大的临床异质性使得诊断和治疗面临严峻挑战。乳腺癌有多种亚型,而人的正常乳腺有三种上皮细胞(激素响应型腔面细胞:LumHR、分泌型腔面细胞:LumSec和基底-肌上皮细胞:MyoEpi)。不同亚型的乳腺癌分别是由哪种正常上皮细胞演化而来一直没有直接证据。正确鉴定不同乳腺癌的起源、以及导致后续乳腺癌增殖和演化的基因,是攻克乳腺癌的关键。然而,由于祖先克隆群体存在比例低,突变少,只有通过高通量、高基因组分辨率的单细胞基因组和转录组共测序技术,才能鉴定该群体,并同时获得该群体的表型,这在技术上一直是个巨大挑战。
为了克服这一挑战,研究组开发了高通量、高基因组分辨率的单细胞DNA与RNA联合测序方法——wellDR-seq。该方法通过对DNA和RNA的生化反应进行反复优化,并结合双重索引标记技术和纳升小孔芯片技术,首次实现了同时对数千个单细胞的基因组和转录组进行联合测序解析。研究组通过对MDA-MB-231细胞系的双组学数据分析,发现仅通过scRNA-seq数据推断的拷贝数信息并不可靠。这一发现不仅挑战了现有的仅依靠单细胞转录组分析DNA克隆结构的局限,更强调了直接对DNA和RNA进行联合测序在揭示肿瘤真实演化路径中的不可替代性。
在这项研究中,研究组在4名ER阳性患者中成功识别了肿瘤的祖先亚克隆。这些祖先亚克隆携带着少量拷贝数变异(CNAs),随后在肿瘤进展过程中获取更多CNAs并大规模扩增,最终形成了主要的肿瘤细胞群体。通过wellDR-seq,研究人员发现所有这些祖先细胞都源自LumHR细胞谱系,这表明LumHR细胞是ER阳性乳腺癌的起源细胞。研究人员还发现在非癌性细胞中也存在偶发的CNAs。这些CNAs不仅存在于上皮细胞中,也存在于基质细胞中。在上皮细胞中,这些突变细胞主要存在于两中腔面型(LumSec和LumHR)细胞中,而未在MyoEpi中发现,且这些突变主要发生在常染色体上。而存在于基质细胞中的突变主要发生在X染色体上。这一发现提示,腔面型上皮更容易导致肿瘤的发生,为肿瘤发生的早期预警提供了新的思路。
此外,本研究首次在单细胞层面系统性地量化了基因拷贝数变化对基因表达的影响。研究发现,在染色体片段水平,56%的CNAs与基因表达变化正相关。在这56%的CNAs中,基因表达量的增加与拷贝数的增加的相关性是接近线性的。出人意料的是,作者通过比较肿瘤亚克隆间的差异表达基因,发现这些基因绝大多数(69%)都定位于拷贝数没有变化的区域,而非拷贝数变化的区域。另外,作者还发现在单个基因层面上,拷贝数变化和基因表达变化也存在很大差异。研究将基因分为两类:“剂量敏感性”基因:如PGR、AURKA和RB1。这些基因的表达水平与拷贝数变化显著相关,其表达量会随着基因拷贝数的增减而同步变化。“剂量不敏感性”基因:如PIK3CA、BRCA1和TP53。这些基因的表达水平与拷贝数变化无关。即使基因拷贝数发生变异,其表达水平仍保持稳定。这一发现为理解肿瘤的遗传学和功能学提供了新的视角,解释了为何某些基因突变或拷贝数变异会强烈驱动肿瘤的进展,而另一些则不然。
该研究不仅开发了高通量的单细胞基因组和转录组共测序技术,而且系统解析了乳腺癌的起源并定量表征了基因剂量效应。wellDR-seq是一种通用技术,可被广泛应用于研究不同肿瘤的起源和演化、研究基因型与表型的互作。除癌症研究外,wellDR-seq 在生物学和生物医学的多个领域都将具有广泛的应用,包括产前基因检测、DNA复制、发育生物学、神经科学、正常组织嵌合体、衰老以及微生物学等。
分子细胞卓越中心王开乐研究员和MD安德森癌症中心的叶睿博士为该论文的共同第一作者,王开乐研究员和Nicholas Navin教授为共同通讯作者。该项工作得到分子细胞卓越中心细胞高性能计算平台的帮助和支持。
文章链接:https://www.cell.com/cell/abstract/S0092-8674(25)00926-2
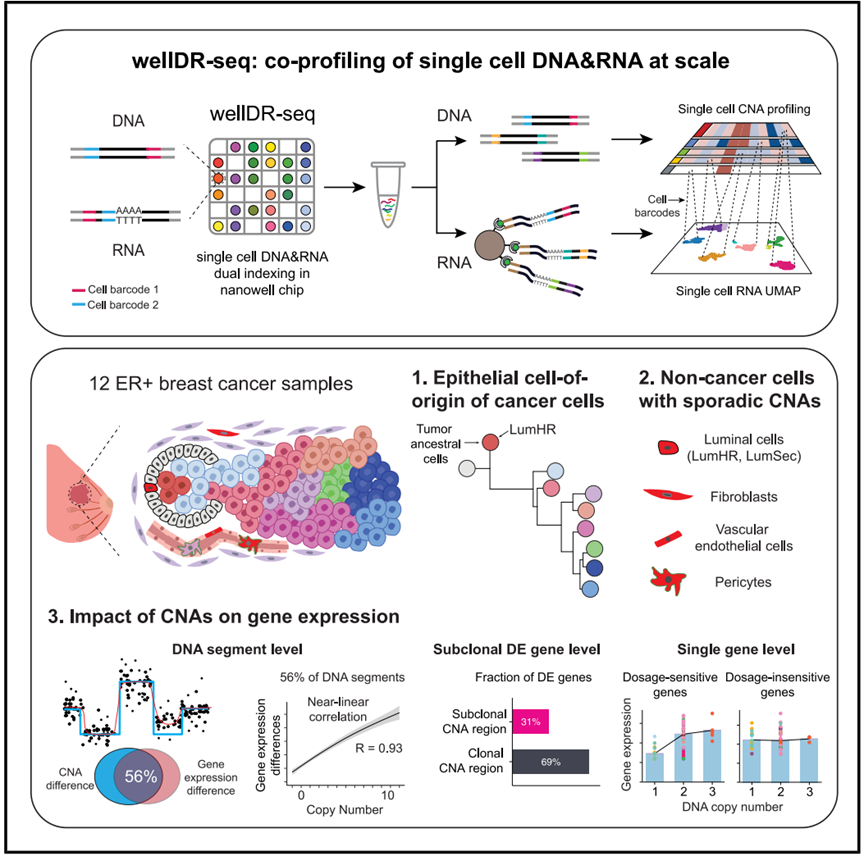
wellDR-seq技术实现乳腺癌样本的高通量单细胞全基因组与转录组的联合分析

