9月17日,中国科学院上海营养与健康研究所邱菊研究组与秦骏研究组合作,在Journal of Allergy and Clinical Immunology期刊,在线发表了题为“Brg1-imprinted chromatin status controls effector and memory group 2 innate lymphoid cell metabolism to exacerbate allergic lung inflammation”的研究成果。该研究揭示了染色质重塑因子Brg1通过调控2型天然淋巴细胞(ILC2)的染色质状态,增强其有氧糖酵解代谢,进而促进效应型ILC2(ILC2eff)和记忆型ILC2(ILC2mem)扩增,加剧过敏性肺部炎症的分子机制。这一发现不仅阐明了哮喘发病与复发的关键分子机制,也为哮喘等过敏性疾病的治疗提供了新的潜在靶点。
过敏性哮喘是一种全球高发的慢性呼吸道疾病,其发病与免疫系统过度激活密切相关。核心病理特征是气道高反应性、嗜酸性粒细胞浸润及黏液过度分泌,严重影响患者生活质量,甚至危及生命。长期以来,研究认为辅助性T细胞2(Th2细胞)是驱动哮喘的关键免疫细胞,但近年发现一类名为“ILC2”的固有免疫细胞同样扮演着核心角色——它们无需抗原激活,就能快速响应环境刺激(如花粉、尘螨、蛋白酶等过敏原),分泌IL-5、IL-13等炎症因子,直接诱发气道炎症。
更重要的是,近来研究表明ILC2同样具有“免疫记忆”特性。ILC2在初次接触过敏原后能够形成“记忆”,再次接触低剂量过敏原或炎症信号(如IL-33),就会迅速活化并大量扩增,引发更强烈的“二次炎症”,这也是哮喘反复发作、难以根治的重要原因。然而,ILC2如何形成并维持这种记忆能力,其背后的表观遗传调控机制尚不明确。
为了探究这一问题,研究人员首先通过多组学分析发现,在小鼠过敏性肺部炎症模型中,染色质重塑复合物mSWI/SNF的核心成分Brg1(由Smarca4基因编码)表达显著上调。炎症因子IL-33(哮喘中诱导ILC2活化的关键信号)直接诱导ILC2表达Brg1,提示Brg1可能是ILC2活化的“关键开关”。进一步实验表明,Brg1在ILC2活化过程中能够结合并开放一系列染色质区域,特别是与细胞代谢相关的基因位点。值得注意的是,Brg1通过增强Hif1a和Ldha等关键代谢基因的染色质可及性,促进ILC2的糖酵解过程,从而支持其扩增与存活。
研究团队还发现Brg1所塑造的这种“代谢印记”能够从效应ILC2保留至记忆ILC2,使得记忆细胞在再次接触过敏原时仍能维持高水平的糖酵解活性和快速反应能力。在动物模型中,通过特异性敲除ILC2中的Smarca4或Hif1a基因,显著抑制ILC2扩增,减轻急性和继发性肺部炎症,证明Hif1α是连接Brg1与ILC2记忆特性的关键分子。
在临床转化方面,研究人员进一步使用Brg1的小分子抑制剂Compound 14进行干预,发现其不仅能有效缓解小鼠过敏性肺部炎症,还在抑制ILC2记忆反应方面表现出优于传统激素(地塞米松)的效果,提示靶向Brg1可能成为治疗哮喘等过敏性疾病的潜在新策略。
该研究首次揭示了Brg1通过调控ILC2的染色状态影响其代谢,连接效应与记忆ILC2功能的表观遗传机制,不仅深化了对哮喘发病机制的理解,也为开发针对记忆免疫细胞的精准疗法提供了新思路。
中国科学院上海营养与健康研究所博士研究生唐聚培,上海交通大学医学院附属同仁医院检验科副主任医师孙寒晓为论文共同第一作者。中国科学院上海营养与健康研究所邱菊研究员、秦骏研究员与邱金馨副研究员为文章共同通讯作者。本研究得到了中国科学院上海药物研究所苏枭研究员,上海交通大学邹强研究员、沈蕾研究员、盛慧明教授,安徽医科大学周洪教授,清华大学郭晓欢教授,山东大学李石洋教授,中国科学院上海营养与健康研究所邵振和杨立峰研究员的大力支持和帮助。该研究得到了国家科学技术部、国家自然科学基金委员会和上海市科学技术委员会的资助,同时也得到了中国科学院上海营养与健康研究所所级公共技术中心的支持。
文章链接:https://doi.org/10.1016/j.jaci.2025.08.029
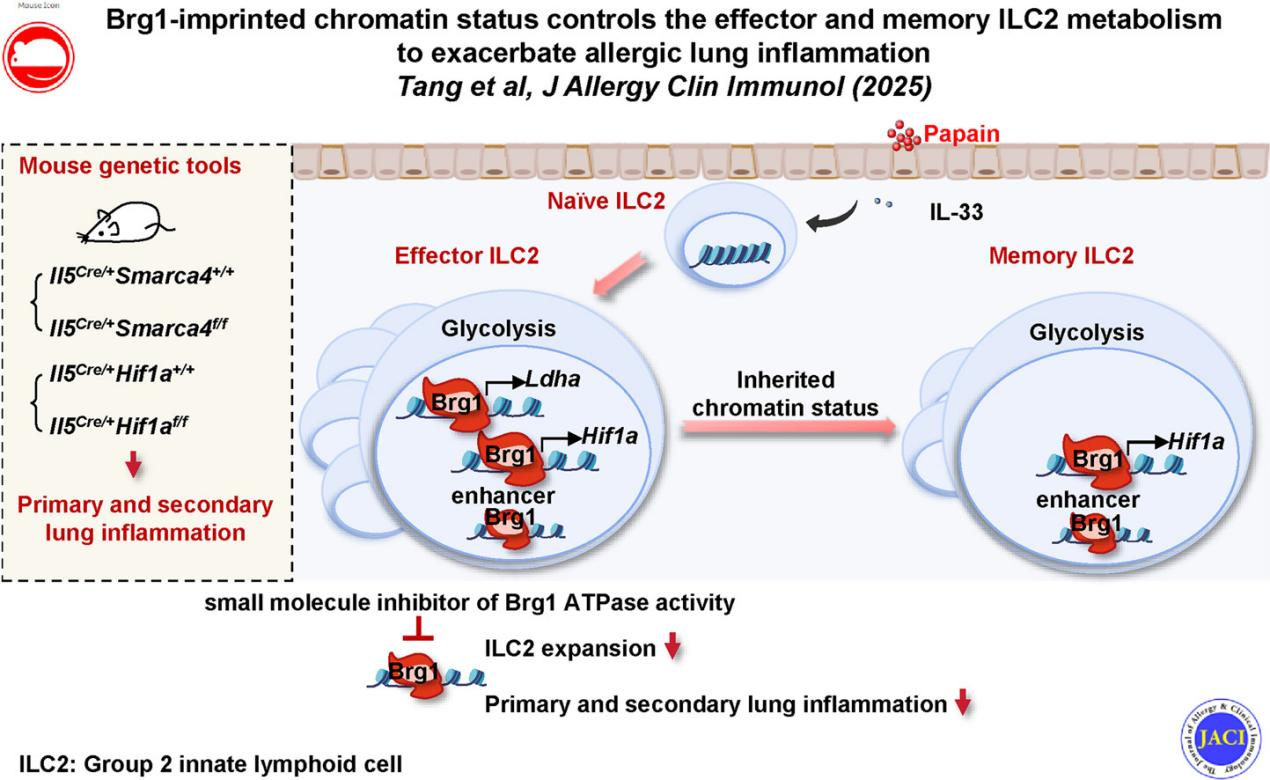
图:Brg1通过调控ILC2的染色质状态,加剧过敏性肺部炎症

