2025年10月11日,Science Advances在线发表了中国科学院分子植物科学卓越创新中心张鹏与上海师范大学生命科学学院俞芳团队合作完成的题为Molecular mechanism underlying phosphate distribution by SULTR family transporter SPDT inOryza sativa的研究论文。该研究通过解析水稻磷酸盐分配关键蛋白SPDT的三维结构与生化功能分析,揭示了SPDT特异性识别并转运磷酸盐的分子机制。
磷是植物生长发育所必需的大量营养元素。然而,土壤中无机磷(Pi)含量通常较低,限制了农作物产量,是全球农业生产面临的重要挑战。植物依靠多种Pi转运蛋白协同完成磷的吸收、转运与分配:位于根部的PHT1家族蛋白介导土壤中Pi的吸收,PHO1负责将Pi从根向地上部分的转运,SPDT则调控Pi在节部组织中的分配,并进一步影响Pi向籽粒的转运,VPE蛋白与PHT2/3/4/5蛋白则参与亚细胞水平的Pi稳态调控(图1)。
尽管上述Pi转运蛋白在植物磷稳态中发挥关键作用,但是其结构与分子与调控机制仍大部分未知。张鹏研究团队在前期研究中报道了首个植物Pi转运蛋白的三维结构,揭示了PHO1(H1)识别与转运Pi、及受高磷信号分子InsP的调控机制(Fang et al,Nat Plants,2025,doi: 10.1038/s41477-024-01895-6)。
本研究中,研究人员聚焦水稻(Oryza sativa)中位于节间参与籽粒Pi分配的关键蛋白OsSPDT(即SULTR3;4)开展研究。OsSPDT属于硫酸盐转运蛋白SULTR家族,却特异性地转运磷酸盐。SPDT如何实现从硫酸盐向磷酸盐转运的功能演化,其分子机制一直未被揭示。
研究人员首先通过酵母异源互补实验验证了SPDT特异性转运Pi且不转运硫酸盐的功能(图2a)。随后利用单颗粒冷冻电镜技术解析了OsSPDT与磷酸根结合前后状态的高分辨率三维结构。结构显示,OsSPDT以同源二聚体形式存在,每个单体包含N端胞内结构域(NTD)、跨膜结构域(TMD)和C端STAS结构域(图2b)。TMD可进一步分为Core和Gate两个亚结构域,磷酸根结合位点位于二者界面处。基于结构的分析与转运功能实验,发现将SULTR的TMD与OsSPDT的TMD置换可使OsSPDT获得硫酸盐的转运活性;进一步分析发现TM3上的Ser170是SPDT家族在结合位点的特征性残基,单个位点突变会导致磷酸盐转运功能丧失,但并不能获得硫酸盐的转运能力,说明磷酸盐识别的特异性可能依赖于整个TMD的协同进化。
此外,本研究还发现NTD和STAS结构域对维持二聚体稳定性和转运活性至关重要。NTD的49–55氨基酸对于维持OsSPDT的二聚化及功能的必不可少(图2c)。STAS结构域则通过静电相互作用稳定相邻单体的TMD,参与调控转运过程中的构象变化。
至此,植物中两类不同家族的无机磷转运蛋白PHO1;H1(SPX-EXS家族)和SPDT(SULTR家族)的三维结构组成、底物识别/转运与调控机制得到了深入解析。鉴于两类蛋白在磷的长距离运输(PHO1)与组织分配(SPDT)层面所起的关键作用,本研究在揭示植物磷稳态调控分子机制的同时,也为培育低植酸、高磷利用效率的作物品种奠定了基础(图3)。
中国科学院分子植物科学卓越创新中心博士后方孙贞合为本文第一作者,上海师范大学生命科学学院硕士生赵阳(已毕业)与张鹏组助理研究员张雪共同参与了研究。张鹏研究员和俞芳副教授为共同通讯作者。本研究的冷冻电镜数据收集和蛋白样品分析得到了复旦大学和中国科学院分子植物科学卓越创新中心公共技术中心的支持和帮助。本研究得到了国家自然科学基金委、中国科学院及上海市项目的资助。
原文链接:https://www.science.org/doi/10.1126/sciadv.ady3442
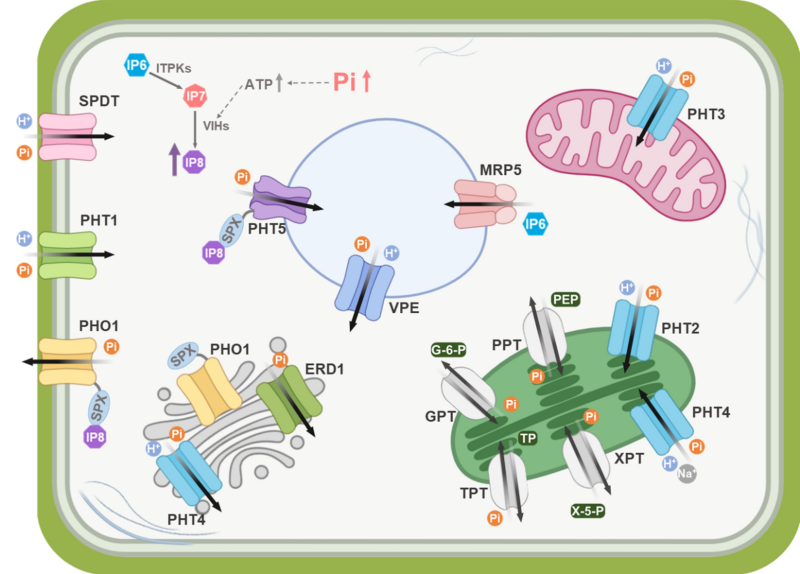
图1 植物磷酸盐运输系统
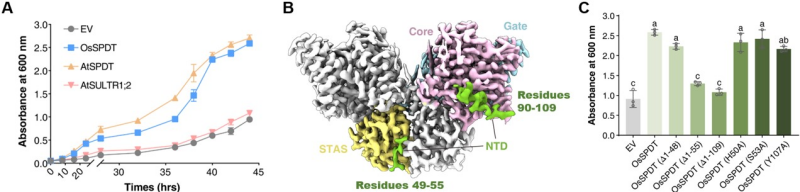
图2 OsSPDT的结构与功能分析
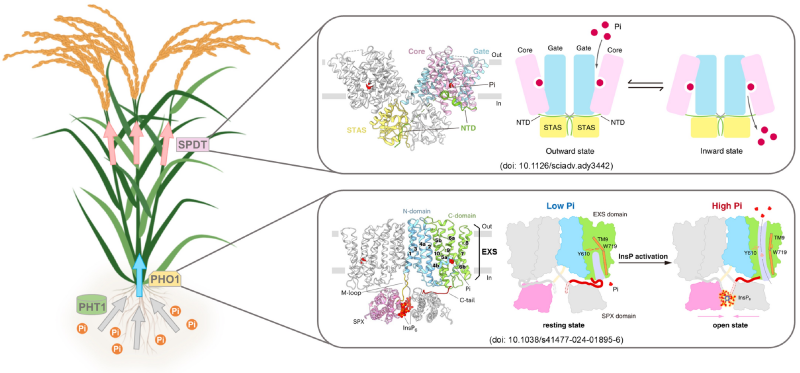
图3 SPDT和PHO1的工作模型

